Trypsinogeen
Definitie - Wat is trypsinogeen?
Trypsinogeen is de inactieve voorloper, een zogenaamde Proenzyme, een enzym gemaakt in de alvleesklier, genaamd de alvleesklier. Samen met de resterende pancreassecretie, de zogenaamde pancreas, komt het pro-enzym trypsinogeen via de pancreaskanalen vrij in de twaalfvingerige darm, een deel van de dunne darm. Dit is waar activering van het enzym trypsine plaatsvindt.
Dit enzym heet "Hydrolase"gecategoriseerd, dat wil zeggen, het is in staat om verbindingen tussen individuele aminozuren te splitsen. Dit proces vindt plaats in de Dunne darm in plaats daarvan, die de eiwitten die via voedsel worden ingenomen, afbreekt in kleinere fragmenten van aminozuren, waardoor ze in het lichaam kunnen worden opgenomen.

Hoe wordt de activering van trypsine uitgevoerd?
De activering van trypsinogeen tot trypsine kan op twee verschillende manieren plaatsvinden. In beide gevallen vindt activering niet plaats in het gebied van de alvleesklier of zijn kanalen, maar alleen in het gebied van de twaalfvingerige darm, een deel van de dunne darm.
- Een ander enzym is nodig voor een mogelijkheid tot activering van trypsine. Dit enzym wordt geproduceerd in de brush border, d.w.z. de oppervlakkige cellen, van de twaalfvingerige darm. Het heet Enteropeptidase of Enterokinase. Het enzym is een van de Hydrolasen gecategoriseerd. Dit betekent dat ze de verbindingen van individuele aminozuren, die het pro-enzym trypsinogeen zijn structuur geven, omkeerbaar kunnen splitsen door watermoleculen te consumeren. Wanneer trypsinogeen wordt geactiveerd tot trypsine, wordt een keten van zes aminozuren, een zogenaamd hexapeptide, afgesplitst van het pro-enzym trypsinogeen tijdens het consumeren van water. Hierdoor ontstaat een verkorte aminozuurketen in vergelijking met vroeger. Het proces wordt aangeroepen beperkte proteolyse. Het enzym bevindt zich nu echter in zijn actieve vorm en kan verdere aminozuurketens splitsen om eiwitten af te breken en te verteren.
- De tweede variant van het activeren van trypsinogeen voor trypsine wordt vertegenwoordigd door het reeds actieve enzym trypsine. Trypsine kan niet alleen vreemde eiwitten splitsen in kleinere aminozuurketens, maar kan ook de lichaamseigen pro-enzymen zoals trypsinogeen met verschillende aminozuren verkorten. Trypsine houdt vooral van splitsen na het zesde aminozuur van trypsinogeen. Dit betekent dat een hexapeptide wordt afgesplitst, dat het trypsinogeen omzet in zijn actieve vorm, trypsine. Naast trypsinogeen kan actief trypsine drie andere enzymen die belangrijk zijn voor de spijsvertering, omzetten in hun actieve vorm. Twee factoren die in eerste instantie niet duidelijk zijn, zijn ook belangrijk voor activering. Enerzijds is de werking van trypsine vooral goed bij een licht basische pH-waarde van 7 tot 8, waardoor trypsinogeen steeds meer wordt geactiveerd. Aan de andere kant wordt trypsinogeen afgegeven in de pancreas met een trypsineremmer. Dit voorkomt voortijdige activering in de alvleesklier en wordt alleen afgebroken in de twaalfvingerige darm.
Waar wordt trypsinogeen gemaakt?
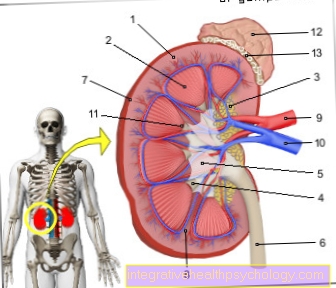
Het pro-enzym trypsinogeen wordt grofweg geformuleerd in de alvleesklier. Dit liegt over de bovenbuik links van de maag. De alvleesklier kan nog steeds in twee delen worden verdeeld:
- Van de endocriene deel produceert hormonen zoals insuline voor de regulering van de suikerbalans, die in het lichaam werken.
- Van de exocriene deeldie het grootste deel van de alvleesklier vormt, produceert de alvleesklier, het pro-enzym Trypsinogeen en speelt een belangrijke rol bij de spijsvertering.
Mogelijk bent u ook geïnteresseerd in: Functies van de alvleesklier
Wat zijn de normale waarden?
Omdat trypsinogeen normaal gesproken door de kanalen van de alvleesklier rechtstreeks in de dunne darm wordt geleid, is er meestal geen trypsinogeen in het bloed, wat betekent dat de normale waarden nul benaderen.
Als het zo is dat trypsinogeen in het bloed wordt gedetecteerd, spreekt de bevinding zeker voor een pathologisch proces. Hier komt bijvoorbeeld een acute Pancreatitis en een Taaislijmziekte in kwestie. Trypsine wordt getest als onderdeel van de screening op pasgeborenen.
Wat heeft trypsinogeen te maken met cystische fibrose?
Bij cystische fibrose, ook wel cystische fibrose genoemd, resulteert een mutatie in het genoom in een verandering in de samenstelling van de secretie van klieren, die hun secretie afgeven aan het oppervlak van het lichaam, zoals de darm. De afscheiding wordt beduidend stroperiger, waardoor deze langzamer kan worden afgegeven.
Dit is vooral kritiek in het geval van de alvleesklier. Door de langere verblijftijd in de doorgangen van de alvleesklier heeft de secretie een verhoogd effect in het orgaan. Omdat trypsinogeen ook in toenemende mate wordt geactiveerd tot trypsine, vindt vertering van het eigen lichaam plaats, wat kan resulteren in acute pancreatitis.
Meer informatie over het onderwerp vindt u hier: Taaislijmziekte
Wat is trypsine?
Trypsine is een enzym dat ontstaat uit een inactieve precursor, het pro-enzym trypsinogeen, en speelt een belangrijke rol bij de vertering van eiwitten. Het pro-enzym trypsinogeen komt uit het exocriene deel van de pancreas. Dit pro-enzym wordt op twee verschillende manieren geactiveerd. Enerzijds wordt met behulp van het enzym enteropeptidase een aminozuurketen van zes aminozuren afgesplitst. Aan de andere kant kan trypsine zichzelf activeren. Ook hier wordt een aminozuurketen van zes aminozuren afgesplitst. Actieve trypsine kan ook de drie pro-enzymen doen Procarboxypeptidasen, Proaminopeptidasen en Chymotrypsinogeen omzetten in hun drie actieve enzymen door een aminozuurketen af te splitsen. Deze drie enzymen zijn ook betrokken bij de vertering van eiwitten.
Trypsine is geclassificeerd als een enzym in de categorie Hydrolasen gecategoriseerd. Dit betekent dat ze omkeerbaar verbindingen tussen aminozuren kunnen splitsen door water te consumeren. Het vermogen om aminozuurketens te splitsen bereikt een maximum in de licht basische pancreas met pH-waarden tussen 7 en 8. Deze eigenschap is essentieel voor het spijsverteringsproces.
Na de enzymen in het speeksel van de mond, vertegenwoordigt trypsine de tweede stap in de splitsing van eiwitten. Het enzym splitst niet de aminozuurketen van de eiwitten van buitenaf, maar verdeelt de hele keten in verschillende kleine fragmenten, die vervolgens worden ingekort door andere enzymen zodat ze kan via het darmslijmvlies in het lichaam worden opgenomen.
Meer informatie vind je hier: Trypsine
Wat gebeurt er met een trypsinedeficiëntie?
Bij een tekort aan trypsine wordt de vertering van eiwitten verstoord. In het volgende worden minder aminozuren in het lichaam opgenomen. Aangezien sommige aminozuren essentieel zijn voor het menselijk lichaam, aangezien ze niet kunnen worden geproduceerd door middel van modificatie van bestaande aminozuren of door hun eigen synthese, treden na verloop van tijd deficiëntieverschijnselen op, die ernstige gevolgen kunnen hebben als ze niet worden behandeld.
Daarnaast kan het gebeuren dat de aminozuurvoorraden van het lichaam, zoals de eiwitten in de spieren, worden benut, wat leidt tot gewichtsverlies en verminderde veerkracht.
Alfa-1 antitrypsinedeficiëntie
Alfa-1-antitrypsinedeficiëntie wordt vaak veroorzaakt door een genetisch defect. Alfa-1-antitrypsine is een enzym dat de werking van andere enzymen remt. De enzymen die daarbij worden geremd, hebben normaal gesproken de taak eiwitten af te breken, waardoor ze hun functie verliezen. Alpha-1-Antitrypsin kan dus ook worden gebruikt als Proteïnase-remmer zijn aangewezen.
De enzymen die worden geremd door Alpha-1-Antitrypsin komen voornamelijk voor bij ontstekingsprocessen en zijn dat vooral Chymotrypsine, trypsine, plasmine, elastase en Trombine.
De remming van elastase is hier van bijzonder belang. In de regel breekt elastase elastine af, dat voornamelijk in de longen wordt aangetroffen. Elastine is een structureel eiwit dat grotendeels verantwoordelijk is voor de elasticiteit van de longen. Als er een tekort is aan elastase-remmers zoals alfa-1-antitrypsine, kan dit leiden tot een verhoogde activiteit van elastase in de longen. Hier, zoals overal in het lichaam, breekt elastase eiwitten af, maar dit tast het lichaamseigen weefsel in de longen aan. Dit leidt tot enorme schade aan het longweefsel, wat onvermijdelijk de longfunctie beperkt. De symptomen die eruit ontstaan zijn onder meer Hoesten, kortademigheid en vernauwing van de luchtwegen. Bovendien kan de lever, die voornamelijk verantwoordelijk is voor de aanmaak van elastase, verhoogde leverwaarden vertonen en verder beschadigd raken door galcongestie.
Meer informatie vind je hier: Alfa-1 antitrypsinedeficiëntie
Aanbevelingen van onze redactie
- Trypsine
- Alpha-1 antitrypsine
- Alfa-1 antitrypsinedeficiëntie
- Chymotrypsine - waar is het belangrijk voor?
- Rol van enzymen in het menselijk lichaam